Định nghĩa axit là gì? Phân loại tính chất hóa học và ứng dụng
Trong thế giới hóa học đầy mênh mông, axit là một trong những khái niệm cơ bản và quan trọng nhất. Từ những hiểu biết sơ bộ về axit đến sự ứng dụng rộng rãi của chúng trong cuộc sống hàng ngày và các ngành công nghiệp, chúng ta không thể phủ nhận vai trò to lớn của axit trong sự phát triển của con người và xã hội. Hãy cùng tìm hiểu về định nghĩa, tính chất hóa học và ứng dụng của axit, một trong những “nhân tố” không thể thiếu trong hóa học và cuộc sống hàng ngày của chúng ta.
Định nghĩa axit theo thuyết Arrhenius
Thuyết Arrhenius về axit định nghĩa axit là những chất có khả năng tạo ra ion hydrogen (\(H^+\)) khi pha loãng trong nước. Điều này có nghĩa là trong dung dịch nước, axit sẽ tạo ra \(H^+\) ion và một anion khác. Ví dụ, khi axit clohidric (\(HCl\)) phân li, nó tạo ra ion hydrogen (\(H^+\)) và ion clo (\(Cl^-\))
\[HCl_{(aq)} \rightarrow H^+_{(aq)} + Cl^-_{(aq)}\]
Theo định nghĩa này, mọi chất có khả năng tạo ra ion hydrogen (\(H^+\)) khi pha loãng trong nước đều được coi là axit theo thuyết Arrhenius.
Dưới đây là một ví dụ cụ thể về một axit theo thuyết Arrhenius:
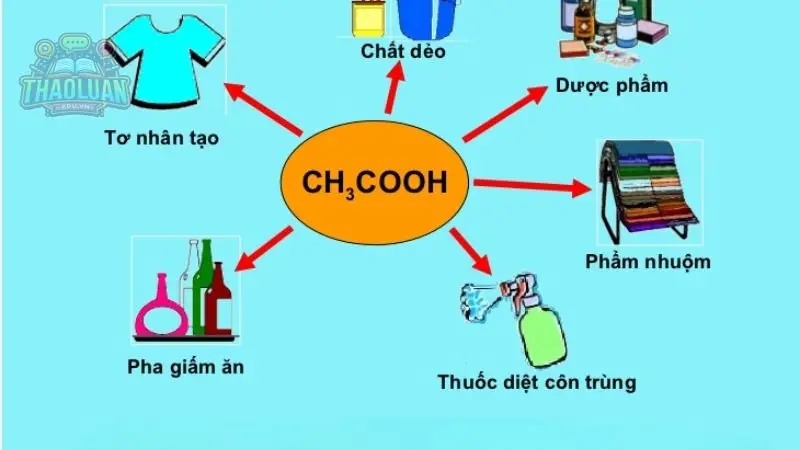
Ví dụ: axit axetic (CH3COOH)
Khi axit axetic (\(CH_3COOH\)) được hòa tan trong nước, nó phân li thành ion hydrogen (\(H^+\)) và ion axetat (\(CH_3COO^-\))
\[CH_3COOH_{(aq)} \rightarrow H^+_{(aq)} + CH_3COO^-_{(aq)}\]
Trong phản ứng này, axit axetic tạo ra ion hydrogen (\(H^+\)) trong dung dịch nước. Do đó, theo định nghĩa của thuyết Arrhenius, \(CH_3COOH\) được coi là một axit.
Định nghĩa axit theo thuyết Brønsted-Lowry
Thuyết Brønsted-Lowry mở rộng định nghĩa của axit so với thuyết Arrhenius bằng cách không yêu cầu môi trường phải là nước. Theo định nghĩa Brønsted-Lowry
Axit: Là chất có khả năng tạo ra ion hydrogen (\(H^+\)). Trong một phản ứng axit, axit chuyển giao một proton (\(H^+\)) cho một chất khác. Ví dụ, trong dung dịch nước, axit nhận diện bởi khả năng tạo ra ion \(H^+\), nhưng trong các dung môi khác cũng có thể làm điều tương tự. Ví dụ, trong dung môi như \(NH_3\) (amoni), axit có thể trao đổi proton với amoni để tạo thành ion amonium (\(NH_4^+\)).
Base: Là chất có khả năng nhận proton (\(H^+\)). Trong một phản ứng cơ sở, base nhận proton từ một chất khác. Ví dụ, trong dung dịch nước, base nhận proton từ axit để tạo thành phân tử nước. Tương tự, trong các dung môi khác, base có thể nhận proton từ các chất khác.
Ví dụ:
Axit
Trong dung dịch nước: \(HCl_{(aq)} + H_2O_{(l)} \rightarrow H_3O^+_{(aq)} + Cl^-_{(aq)}\)
Trong cả hai trường hợp trên, \(HCl\) hoạt động như một axit theo định nghĩa Brønsted-Lowry bằng cách nhả proton (\(H^+\)).
Định nghĩa Brønsted-Lowry mở rộng khái niệm về axit và base, không giới hạn bởi môi trường nước và tạo điều kiện cho việc hiểu sâu hơn về các phản ứng hóa học.
Định nghĩa axit theo thuyết Lewis
Thuyết Lewis mở rộng định nghĩa của axit và base ra khỏi việc tạo ra hoặc nhận proton.
Theo định nghĩa Lewis
Axit: Là bất kỳ chất nào có khả năng nhận một cặp electron để tạo thành liên kết. Axit theo thuyết Lewis không nhất thiết phải chứa hydrogen như trong trường hợp thuyết Brønsted-Lowry. Một axit Lewis có thể là một phân tử hoặc một ion có khả năng nhận electron từ một chất khác để tạo thành liên kết cộng hóa trị.
Base: Là bất kỳ chất nào có khả năng nhả một cặp electron để tạo thành liên kết. Một base Lewis có thể là một phân tử hoặc một ion có khả năng đóng góp electron cho một axit để tạo thành liên kết cộng hóa trị.
Trong định nghĩa của Lewis, một phản ứng axit-base không nhất thiết phải liên quan đến proton như trong trường hợp của Brønsted-Lowry, mà có thể liên quan đến việc chuyển động của các cặp electron.
Ví dụ:
Axit Lewis: \(BF_3\) (boron trifluoride)
Trong \(BF_3\), boron có một lỗ trống trong vòng liên kết và có khả năng nhận một cặp electron từ một chất khác để tạo thành một liên kết.
Base Lewis: \(NH_3\) (ammonia)
Trong \(NH_3\), nitơ có một cặp electron không được tham gia vào liên kết hóa học. Do đó, nó có khả năng đóng góp cặp electron này cho một axit Lewis.
Khi \(NH_3\) tương tác với \(BF_3\), một cặp electron từ \(NH_3\) được chuyển giao cho \(BF_3\) để tạo thành một liên kết cộng hóa trị. Do đó, \(NH_3\) đóng vai trò là base Lewis, trong khi \(BF_3\) đóng vai trò là axit Lewis.
Tính chất của axit
Axit có một số tính chất quan trọng, bao gồm
Tính chất ăn mòn: Axit có khả năng phá hủy các chất và tạo ra ăn mòn. Điều này là do khả năng của axit để tạo ra các ion \(H^+\), khiến chúng tương tác với các chất khác và gây ra sự phân hủy hoặc thay đổi cấu trúc.
Tính chất đắng: Một số axit có thể có vị đắng, đặc biệt khi chúng ở trong dạ dày hoặc nồng độ cao. Ví dụ, acid citric trong quả cam có thể tạo ra hương vị đắng.
Tính chất tác dụng với kim loại: Axit có khả năng tác dụng với kim loại để tạo ra muối và khí hydrogen. Điều này thường xảy ra trong các phản ứng axit với kim loại như axit clohidric tác dụng với kẽm để tạo ra muối kẽm cloua và khí hydro.
Tính chất làm đổi màu: Một số axit có thể tác động đến các chất chỉ thị và gây ra sự thay đổi màu sắc trong các phản ứng axit-base.
Tính chất phản ứng với base: Axit tác động với các base để tạo ra nước và muối.
Tính chất đắng khi mạnh đặc biệt: Các axit mạnh khi dễ dàng tạo ra \(H^+\) ion có thể có vị đắng khi chúng được nếm dưới dạng đặc hoặc nồng độ cao.
Tính chất cụ thể của mỗi loại axit có thể khác nhau tùy thuộc vào cấu trúc hóa học và môi trường phản ứng.

Phân loại axit
Axit có thể được phân loại dựa trên một số tiêu chí khác nhau, bao gồm nguồn gốc, cấu trúc, hoặc tính chất hóa học. Dưới đây là một số cách phân loại axit phổ biến
Phân loại dựa trên nguồn gốc
Axit vô cơ: Đây là axit được tạo ra từ các phản ứng hóa học của các hợp chất không chứa cacbon. Ví dụ: axit clohidric (\(HCl\)), axit nitric (\(HNO_3\)).
Axit hữu cơ: Đây là axit được tạo ra từ các phản ứng hóa học của các hợp chất chứa cacbon. Ví dụ: axit axetic (\(CH_3COOH\)), axit citric (\(C_6H_8O_7\)).
Phân loại dựa trên cấu trúc
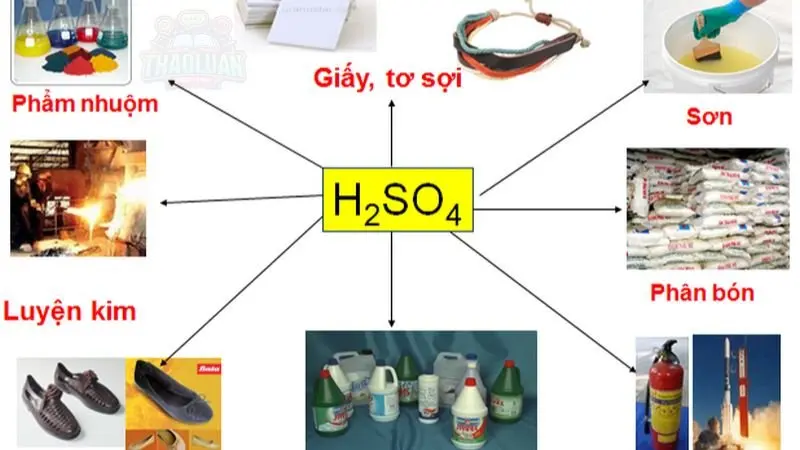
Axit đơn giản: Là axit chỉ chứa một nhóm axit trong phân tử của chúng. Ví dụ: axit clohidric (\(HCl\)), axit sulfuric (\(H_2SO_4\)).
Axit phức tạp: Là axit chứa nhiều hơn một nhóm axit trong phân tử của chúng. Ví dụ: axit phosphoric (\(H_3PO_4\)), axit citric (\(C_6H_8O_7\)).
Phân loại dựa trên tính chất hóa học
Axit mạnh: Là axit có khả năng hoàn toàn phân li thành \(H^+\) và ion phản ứng mạnh với base. Ví dụ: axit hydrochloric (\(HCl\)), axit sulfuric (\(H_2SO_4\)).
Axit yếu: Là axit không phân li hoàn toàn trong dung dịch nước và chỉ phân li một phần nhỏ để tạo ra \(H^+\). Ví dụ: axit axetic (\(CH_3COOH\)), axit carbonic (\(H_2CO_3\)).
Những phân loại này có thể không hoàn toàn độc lập và một axit có thể thuộc vào nhiều nhóm phân loại khác nhau tùy thuộc vào tiêu chí đánh giá.
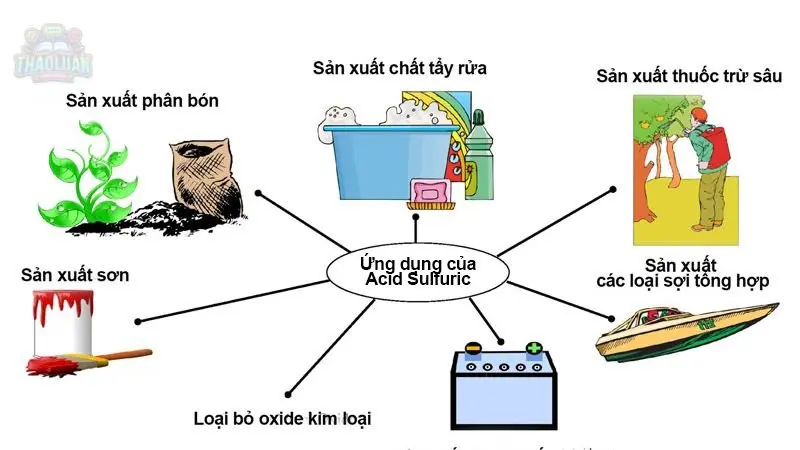
Ứng dụng của axit
Axit có rất nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau, bao gồm
Công nghiệp hóa chất
Axit được sử dụng trong sản xuất các chất phụ gia, polyme, và các hợp chất hữu cơ khác.
Axit được sử dụng trong quá trình tổng hợp hóa học và tẩy rửa công nghiệp.
Dược phẩm
Axit được sử dụng trong sản xuất các loại thuốc và các dung dịch y tế.
Các axit như axit salicylic được sử dụng trong sản xuất thuốc chống vi khuẩn và chống viêm.
Nông nghiệp
Axit được sử dụng trong sản xuất phân bón và thuốc trừ sâu.
Nhiều loại axit được sử dụng để điều chỉnh độ pH của đất trong nông nghiệp.
Công nghiệp thực phẩm và đồ uống
Axit được sử dụng như chất chua trong sản xuất thực phẩm và đồ uống.
Các axit như axit citric và axit acetic được sử dụng như chất tạo mùi và chất bảo quản trong sản xuất thực phẩm.
Chế biến kim loại
Axit được sử dụng trong quá trình tẩy rửa, làm sạch và mạ kim loại.
Axit được sử dụng để loại bỏ oxit và các tạp chất khác từ bề mặt của các sản phẩm kim loại.
Công nghệ môi trường
Axit được sử dụng trong quá trình xử lý nước thải và xử lý chất thải hữu cơ.
Axit được sử dụng để điều chỉnh độ pH trong nước và môi trường đất.
Công nghệ điện tử
Axit được sử dụng trong quá trình tạo ra các mạch điện tử và bán dẫn.
Axit được sử dụng trong việc làm sạch và ets các bề mặt kim loại trong sản xuất linh kiện điện tử.
Những ứng dụng này chỉ là một phần nhỏ của các ứng dụng của axit trong cuộc sống hàng ngày và trong các ngành công nghiệp khác nhau. Axit đóng vai trò quan trọng trong nhiều khía cạnh của cuộc sống và nền kinh tế toàn cầu.
Nguy cơ khi tiếp xúc với axit
Tiếp xúc với axit có thể mang lại nhiều nguy cơ và nguy hiểm cho sức khỏe và môi trường. Dưới đây là một số nguy cơ khi tiếp xúc với axit
Gây bỏng da và tổn thương: Axit có tính chất ăn mòn mạnh có thể gây bỏng da nghiêm trọng khi tiếp xúc trực tiếp. Việc tiếp xúc với axit có thể gây tổn thương cho da, gây đau đớn và các vấn đề về sức khỏe nghiêm trọng.
Gây tổn thương đến mắt: Axit có thể gây tổn thương nghiêm trọng cho mắt nếu tiếp xúc trực tiếp hoặc bị phun vào mắt. Điều này có thể gây đau đớn, viêm nhiễm và thậm chí mất thị lực nếu không được xử lý kịp thời và chính xác.
Gây hại cho hệ hô hấp: Hít phải hơi axit hoặc hấp thụ axit qua đường hô hấp có thể gây ra các vấn đề về sức khỏe như viêm phế quản, viêm phổi và các vấn đề về hệ hô hấp khác.
Gây ô nhiễm môi trường: Axit có thể gây ô nhiễm cho môi trường nước và đất nếu được xả thải mà không được xử lý đúng cách. Điều này có thể ảnh hưởng đến sinh vật sống trong môi trường nước và đất, gây ra các vấn đề về sinh thái và sức khỏe công cộng.
Nguy cơ về cháy nổ: Một số loại axit có thể tạo ra khí dễ cháy hoặc dễ nổ khi tiếp xúc với các chất khác, tăng nguy cơ về cháy nổ và các tai nạn liên quan đến hỏa hoạn.
Nguy cơ về vật lý và hóa học: Axit có thể gây ra các vấn đề về an toàn vật lý và hóa học nếu không được lưu trữ, vận chuyển và sử dụng một cách an toàn và chính xác.
Vì vậy, việc tiếp xúc với axit đòi hỏi sự cẩn trọng và tuân thủ các biện pháp an toàn đối với cả con người và môi trường.
Biện pháp an toàn khi sử dụng axit
Khi sử dụng axit, việc đảm bảo an toàn là rất quan trọng để ngăn ngừa các tai nạn và bảo vệ sức khỏe của bản thân và môi trường xung quanh. Dưới đây là một số biện pháp an toàn khi sử dụng axit
Đeo trang bị bảo hộ: Luôn đeo bảo hộ cá nhân khi tiếp xúc với axit, bao gồm kính bảo hộ, mặt nạ phòng độc, găng tay hóa học và áo chống hóa chất.
Làm việc trong môi trường thông gió tốt: Luôn làm việc trong môi trường có đủ thông gió để ngăn ngừa hít phải hơi axit.
Lưu trữ an toàn: Lưu trữ axit trong các bình chứa phù hợp và được đánh dấu rõ ràng, xa tầm tay trẻ em và loại trừ tình trạng rò rỉ.
Sử dụng cẩn thận: Sử dụng axit một cách cẩn thận và chính xác theo hướng dẫn của nhà sản xuất. Tránh tiếp xúc trực tiếp với da và mắt.
Xử lý axit một cách an toàn: Khi pha loãng axit hoặc làm việc với axit đặc, luôn thêm axit vào nước (không phải ngược lại) để tránh phản ứng bất ngờ và phun nước nóng. Tránh pha loãng axit quá nhanh để ngăn ngừa sự nóng chảy và tạo ra nhiệt nóng.
Phản ứng khẩn cấp: Biết cách ứng phó với các tình huống khẩn cấp như rò rỉ axit, cháy nổ hoặc tiếp xúc với da và mắt. Có sẵn các trang thiết bị cứu hỏa và cứu thương và biết cách sử dụng chúng.
Vệ sinh và xử lý chất thải an toàn: Xử lý chất thải axit một cách an toàn và đúng cách theo quy định của cơ quan chức năng.
Những biện pháp an toàn này giúp giảm thiểu nguy cơ và bảo vệ sức khỏe khi làm việc với axit. Luôn tuân thủ các hướng dẫn và quy tắc an toàn khi sử dụng axit để đảm bảo môi trường làm việc an toàn và lành mạnh.
Hy vọng bài viết này đã cung cấp cho bạn cái nhìn tổng quan về ứng dụng và an toàn khi sử dụng axit. Việc hiểu rõ về tính chất và nguy cơ của axit là quan trọng để có thể sử dụng chúng một cách hiệu quả và an toàn trong nhiều lĩnh vực khác nhau. Bằng cách tuân thủ các biện pháp an toàn và thực hiện các biện pháp phòng ngừa, chúng ta có thể giảm thiểu nguy cơ và bảo vệ sức khỏe của bản thân, người khác và môi trường.
Chân thành cảm ơn bạn đã đọc và quan tâm đến thông tin này. Hy vọng bạn sẽ áp dụng những kiến thức này một cách thông minh và cẩn thận trong công việc hàng ngày của mình. Nếu bạn có bất kỳ câu hỏi hoặc ý kiến nào, đừng ngần ngại để lại cho chúng tôi biết. Chúng tôi luôn sẵn lòng hỗ trợ bạn.Chúc bạn luôn an toàn và thành công trong mọi hoạt động của mình. Xin cảm ơn và hẹn gặp lại!